L'atovaquone, un médicament utilisé pour traiter le paludisme, est connu pour inhiber la chaîne de transport électronique mitochondriale. Dans cette étude, menée au niveau français par des chercheurs de l’Institut de chimie radicalaire (CNRS / Aix-Marseille Université), un nouvel agent dérivé de l’atovaquone ciblant les mitochondries (Mito-ATO) a été développé afin de prévenir la croissance et la propagation tumorale. Ce travail de recherche a été publié dans la revue Advanced Science.
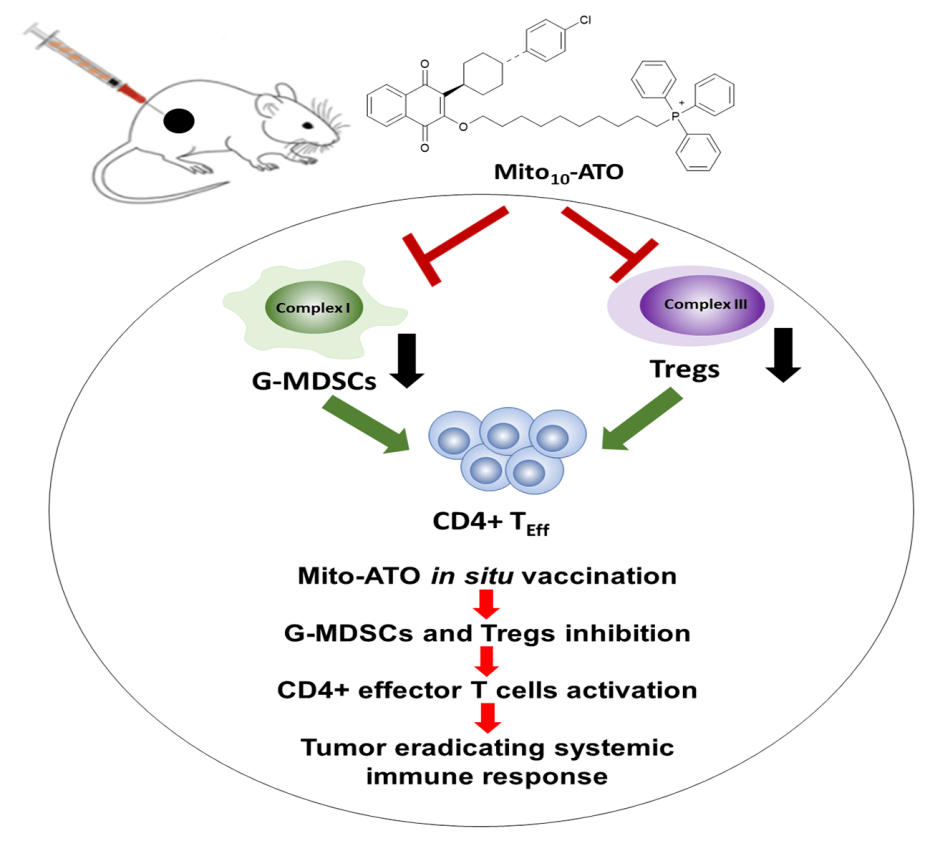
La vectorisation du Mito-ATO permet d’augmenter son accumulation dans les mitochondries de cellules cancéreuses, ainsi que dans les cellules immunosuppressives au sein du microenvironnement immunitaire tumorale (TIME). Ces populations de cellules dites immunosuppressives, telles que les cellules myéloïdes suppressives (g-MDSCs) et lymphocytes T régulateurs (Tregs), sont amplifiées lors de situations pathologiques comme les cancers, d’où la nécessité de réduire leur nombre.
En utilisant une approche de vaccination in situ, l’injection de Mito-ATO dans les tumeurs primaires a déclenché de puissantes réponses immunitaires des lymphocytes T en local, mais aussi dans des sites tumoraux distants. Comme démontré dans des modèles de tumeurs transplantables et dans un modèle de tumeur spontanée, cette réponse immunitaire conduit également à l’attaque des cellules tumorales dans des foyers localisés dans différentes parties du corps. La vaccination in situ avec Mito-ATO empêche la propagation des métastases du cancer des poumons et leur développement dans le cerveau. Par ailleurs, l’analyse par cytométrie en flux a révélé que le traitement par Mito-ATO conduit à une réduction significative des cellules g-MDSCs mais aussi des lymphocytes Tregs au sein du TIME.
La transcriptomique unicellulaire (scRNA-seq) a montré que le traitement par Mito-ATO bloque l’expression des gènes responsables de la phosphorylation oxydative (OXPHOS) et de la glycolyse dans les cellules g-MDSCs et Tregs. Cela conduirait donc à la mort cellulaire de ces cellules au sein du microenvironnement tumoral expliquant la baisse observée lors du traitement par Mito-ATO.
Mito-ATO inhibe l’expression des gènes des complexes I, V, OXPHOS et de la glycolyse dans les cellules g-MDSCs, ainsi que l’expression des gènes des complexes I, III, IV, OXPHOS et de la glycolyse dans les cellules Tregs. La diminution intratumorale des cellules g-MDSCs et Tregs pourrait faciliter l’accroissement observé des lymphocytes T CD4+ infiltrant la tumeur. Ces résultats mettent en lumière l’efficacité antitumorale de Mito-ATO sur de nouvelles cibles (g-MDSCs et Tregs) du TIME.
La stratégie visant à cibler les cellules g-MDSCs et Tregs avec Mito-ATO est donc une approche innovante et attractive permettant de réguler l’immunité tumorale afin de prévenir et de traiter efficacement les cancers et leurs métastases.
En savoir plus : Huang, M., Xiong, D., Pan, J., Zhang, Q., Wang, Y., Myers, C. R., Johnson, B. D., Hardy, M., Kalyanaraman, B., You, M., Prevention of Tumor Growth and Dissemination by In Situ Vaccination with Mitochondria-Targeted Atovaquone. Adv. Sci. 2022, 2101267. https://doi.org/10.1002/advs.202101267
Ces recherches ont été menées par des chercheurs français de l’Institut de chimie radicalaire (CNRS/Aix-Marseille Université) en collaboration avec des chercheurs américains du Medical College of Wisconsin, ainsi que du Houston Methodist Research Institute.
Contact chercheur :
Institut de chimie radicalaire
Micael Hardy - micael.hardy[at]univ-amu.fr